Å knytte det sammen: Affinitet, 'håndtrykk' og multitaskere i cellen
Av David Coppedge, 23. februar 2024. Oversatt herfra.
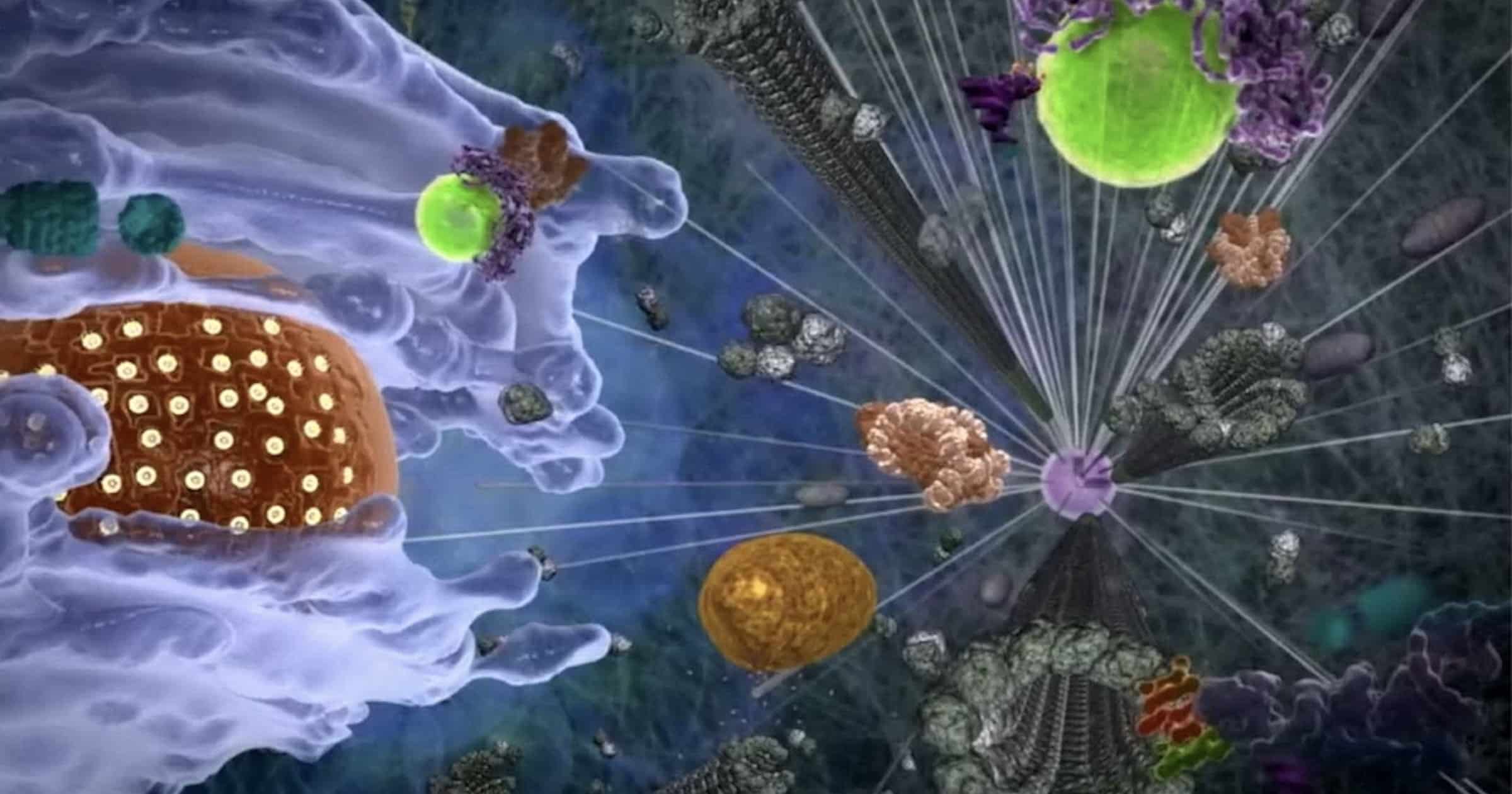 Å styre en celle krever koordinering. Hvordan vet molekyler som beveger seg i det mørke interiøret i en celle hvordan og når den skal koble til noe? Protein tilknytinger tilbyr nye ledetråder, ifølge forskning ved Philipps University i Marburg, Tyskland.
Å styre en celle krever koordinering. Hvordan vet molekyler som beveger seg i det mørke interiøret i en celle hvordan og når den skal koble til noe? Protein tilknytinger tilbyr nye ledetråder, ifølge forskning ved Philipps University i Marburg, Tyskland.
Måtene som organeller og proteiner kobles sammen til rett sted og tid, kommer til syne. En metode er å innkapsle interagerende molekyler innen avdelinger, som kalles kondensater, dråper og flekker. Som kontorer eller avlukker der ansatte kan snakke uten unødig støy, lar disse midlertidige rommene molekyler samhandle i fred (se "Caltech finner en fantastisk rolle for ikke -kodende DNA" -lenke).
Bilde 1. Fra en celles indre -met mikrotubuler (som broer)
En annen metode for koordinering av bevegelige deler involverer snorer som tilknytning (tethers). Visse molekylære maskiner bruker "to hender" for å bringe andre molekyler eller organeller sammen. Visualiser en person som tar en fremmed hånd og bruker den andre hånden til å gripe et dørhåndtak, i det en fører den fremmede til stedet han trenger å være. Mange proteinmaskiner har et kritisk bindingssted for sine mål, men disse "dobbel affinitet" -tetingsmaskiner inneholder to forskjellige gjenkjennelsessteder på forskjellige domener, som gjenkjenner separate mål som trenger å komme sammen. Slike multitaskmaskiner er fantastisk designet for å fremme fellesskap for effektive interaksjoner i den cellulære byen.
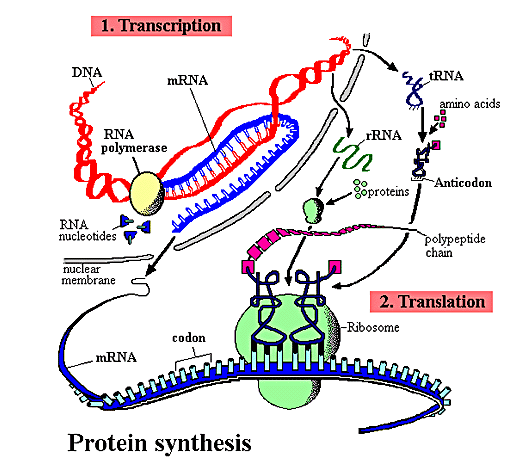 Et lignende fenomen har lenge vært kjent i DNA -oversettelse. Et sett med molekyler kalt aminoacyl-tRNA-syntetaser -lenke bringer forskjellige molekyler sammen. En syntetase føler antikodonet på sitt matchende overførings -RNA (tRNA) og setter deretter den tilsvarende aminosyren i motsatt ende. Som en språkoversetter, trenger hver syntetase å kjenne to språk - DNA -koden og proteinkoden - for å utstyre tRNA med riktig aminosyre. Når det aktiverte tRNA kommer inn i ribosomet, parer dets antikodonbase seg med det komplementære kodonet på messenger -RNA til den ene enden, og aminosyren passer til den voksende polypeptidkjeden i den andre enden. Dette er et spektakulært eksempel på dobbel plikt, multitaskings kunnskap. Men er det bare én?
Et lignende fenomen har lenge vært kjent i DNA -oversettelse. Et sett med molekyler kalt aminoacyl-tRNA-syntetaser -lenke bringer forskjellige molekyler sammen. En syntetase føler antikodonet på sitt matchende overførings -RNA (tRNA) og setter deretter den tilsvarende aminosyren i motsatt ende. Som en språkoversetter, trenger hver syntetase å kjenne to språk - DNA -koden og proteinkoden - for å utstyre tRNA med riktig aminosyre. Når det aktiverte tRNA kommer inn i ribosomet, parer dets antikodonbase seg med det komplementære kodonet på messenger -RNA til den ene enden, og aminosyren passer til den voksende polypeptidkjeden i den andre enden. Dette er et spektakulært eksempel på dobbel plikt, multitaskings kunnskap. Men er det bare én?
Bilde 2. Proteinsyntese -fra DNA
Et annet eksempel på dobbel plikt
Et team av 15 forskere som publiserer i PLoS Biology under hovedforfatter Elena Bittner, også fra Philipps University, og kolleger ved Berkeley og Howard Hughes, har nettopp rapportert et tilfelle av en multitasking -maskin som knytter sammen ulike mål - i dette tilfellet har peroksisomer med mitokondrier, eller de forskjellige målene - i dette tilfellet mitokondrier eller Endoplasmatisk retikulum (er). Det er kanskje ikke det eneste tilfellet av "proteiner som har doble målrettingssignaler [som] kan fungere som bindeledd mellom" organeller, sier de:
"Peroksisomer er organeller med avgjørende funksjoner i oksidativ metabolisme. For å målrette mot peroksisomer, krever proteiner spesialiserte målsignaler. Et mysterium i feltet er sortering av proteiner som bærer et målsignal for peroksisomer, og så vel som for andre organeller, for eksempel mitokondrier eller Endoplasmatisk Retikulum (ER). Når vi undersøkte flere av disse proteinene i soppmodellsystemer, observerte vi at de kan fungere som bindeledd, i det de knytter organeller sammen, for å lage kontaktsteder."
Vær oppmerksom på at de fant dette i gjær, den enkleste av eukaryotene.
Vi viser at i Saccharomyces cerevisiae involverte denne tilknytnings-formingen peroksisomimport-maskineriet, ER-Mitokondrie-møterstrukturen ved mito-kondrier og den guidede inntreden av halerforankrede proteiner -banen på ER.
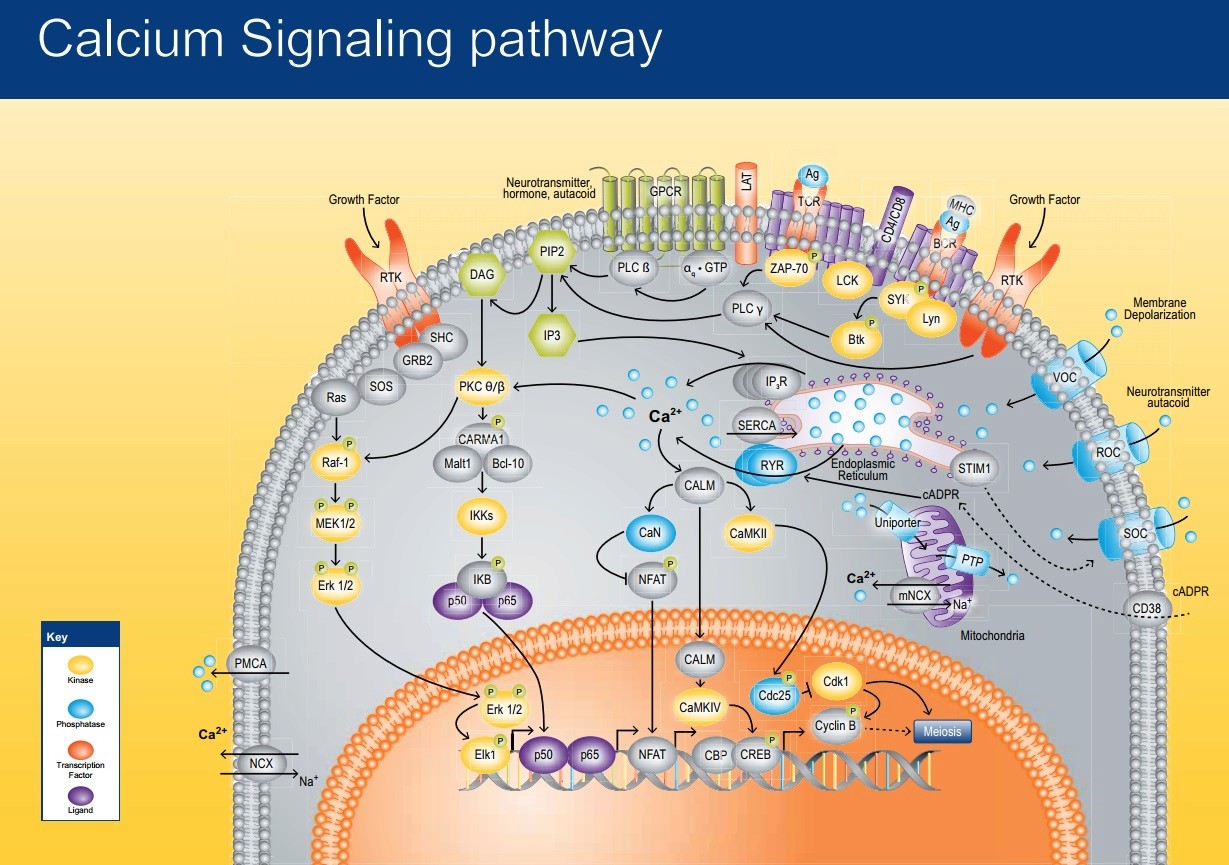 Hvorfor er dette viktig?
Hvorfor er dette viktig?
Våre funn introduserer et tidligere uutforsket begrep om hvordan proteiner med dobbelt affinitet kan regulere organell tilknytning og kommunikasjon.
Tidligere uutforsket: Dette høres ut som en spillveksler. Hvordan fungerer dette "tethering" -systemet? Etter at alt biokjemiarbeidet fra teamet er vist, og demonstrerer dual-målrettingsevnen, illustrerte de det med et forenklet diagram i figur 10 i deres åpne tilgangsartikkel . Som vanlig, selv i forenklet form, involverer systemet mange andre faktorer. Resultatet er beskrevet som følger:
Vi har funnet at distinkte proteiner med målrettingssignaler for 2 organeller kan påvirke nærheten til disse organellene. Denne konklusjonen støttes av forestillingen om at forskjellige typer proteiner med dobbel affinitet Maskiner av forskjellige organeller. Dobbelt målrettede proteiner ser ut til å konsentrere seg i regionene av organellkontakt, noe som kan sammenfalle med regioner med redusert identitet.
Bilde 3. Cellen kommuniserer via signaler
Innenfor mitokondriene møtte vi allerede Tim og Tom -lenke, kanalvaktene som sjekker legitimasjonen til proteiner som utvider organellens ytre og indre membraner. (Forfatterne bemerker at disse translokase -proteinene er "evolusjonært bevart.") Men utenfor mitokondrioney må proteiner som trenger å komme inn eller ut, finne veien til vaktene. Det er der "doble affinitetsproteiner" opererer.
Hvordan ser tilknytningene ut?
PTC5 er et av disse tilknytnings-proteinene, et av mange som "inneholder målrettingssignaler for mitokondrier og peroksisomer til motsatte terminaler." Dets Peroksisom MålrettingsSignal (PMS) gjenkjenner peroksisomet i den ene enden, og dets Mitokondrielle MålSignal (MMS) gjenkjenner TOM ved den mitokondrielle kanalen. Ved å eksperimentre med mutantstammer av dette og tilknyttede proteiner og chaperoner, bekreftet forskerne at PTC5 binder peroksisomer til mitokondrier. Dessuten er aktiviteten avhengig av behov. "Oppsamlet," skriver de, viser disse dataene at binding via doble affinitetsproteiner, er en regulert prosess og avhenger av den metabolske tilstanden til cellen. " Dette innebærer den ekstra evnen til å føle det svingende metabolske behovet.
Forfatterne hadde mye å si om evolusjon. Som vanlig involverte det betydelige mengder spekulasjoner.
"Mens mange peroksisomale membranproteiner kan styre mot peroksisomer uten å gå gjennom ER, har flere peroksisomale membranproteiner utviklet seg til å bli syntetisert i nærheten til ER og kan translokere fra det."
 Annet enn at Tom og Tim ble "evolusjonært bevart" --lenke :-), var det alt de tilbød Darwin.
Annet enn at Tom og Tim ble "evolusjonært bevart" --lenke :-), var det alt de tilbød Darwin.
Bilde 4. Tetherballspill
En ny klasse av aktivitetskoordinatorer
Hva Bittner et al. Har identifisert er sannsynligvis utløseren for et paradigmeskift som angår metoder som celler bruker for å få komponenter sammen.
"Vi konkluderer med at dobbelt målrettet last inkluderer en diverse og uventet gruppe tilknytninger (tethers), som sannsynligvis vil opprettholde kontakt så lenge de forblir tilgjengelige for målretting av faktorer hos partnerorganeller. Kobling av protein- og membranhandel er et vanlig prinsipp i sekretstien , og det kan også forekomme for peroksisomer ved ulike kontaktsteder."
Og så, hva ligger foran oss? Design talsmenn i biokjemi og molekylærbiologi, spiller tetherball! Her er et potensielt fruktbart område for nye funn.
 Hvordan dobbelt målrettede proteiner og omdirigering påvirker fluksen av andre molekyler enn proteiner, for eksempel membranlipider er fortsatt et tema for fremtidig forskning.
Hvordan dobbelt målrettede proteiner og omdirigering påvirker fluksen av andre molekyler enn proteiner, for eksempel membranlipider er fortsatt et tema for fremtidig forskning.
Om forfatteren: DAVID COPPEDGE -kredit til David Coppedge (Bilde 5)
David Coppedge er en frilans vitenskapsreporter i Sør-California. Han har vært styremedlem i Illustra Media siden grunnleggelsen og fungerer som deres vitenskapskonsulent. Han jobbet ved NASAs Jet Propulsion Laboratory (JPL) i 14 år, på Cassini-oppdraget til Saturn, til han ble kastet ut i 2011 for å dele materiale om intelligent design, en diskriminerende handling som førte til en nasjonalt publisert rettssak i 2012. Discovery Institute støttet saken hans, men en ensom dommer dømte ham mot ham, uten forklaring. En naturfotograf, friluftsmann og musiker, David har B.S. grader i realfagsutdanning og i fysikk og holder presentasjoner om ID og andre vitenskapelige emner.
Oversettelse, via google oversetter, og bilder ved Asbjørn E. Lund
 Å styre en celle krever koordinering. Hvordan vet molekyler som beveger seg i det mørke interiøret i en celle hvordan og når den skal koble til noe? Protein tilknytinger tilbyr nye ledetråder, ifølge forskning ved Philipps University i Marburg, Tyskland.
Å styre en celle krever koordinering. Hvordan vet molekyler som beveger seg i det mørke interiøret i en celle hvordan og når den skal koble til noe? Protein tilknytinger tilbyr nye ledetråder, ifølge forskning ved Philipps University i Marburg, Tyskland. Et lignende fenomen har lenge vært kjent i DNA -oversettelse. Et sett med molekyler kalt aminoacyl-tRNA-syntetaser -lenke bringer forskjellige molekyler sammen. En syntetase føler antikodonet på sitt matchende overførings -RNA (tRNA) og setter deretter den tilsvarende aminosyren i motsatt ende. Som en språkoversetter, trenger hver syntetase å kjenne to språk - DNA -koden og proteinkoden - for å utstyre tRNA med riktig aminosyre. Når det aktiverte tRNA kommer inn i ribosomet, parer dets antikodonbase seg med det komplementære kodonet på messenger -RNA til den ene enden, og aminosyren passer til den voksende polypeptidkjeden i den andre enden. Dette er et spektakulært eksempel på dobbel plikt, multitaskings kunnskap. Men er det bare én?
Et lignende fenomen har lenge vært kjent i DNA -oversettelse. Et sett med molekyler kalt aminoacyl-tRNA-syntetaser -lenke bringer forskjellige molekyler sammen. En syntetase føler antikodonet på sitt matchende overførings -RNA (tRNA) og setter deretter den tilsvarende aminosyren i motsatt ende. Som en språkoversetter, trenger hver syntetase å kjenne to språk - DNA -koden og proteinkoden - for å utstyre tRNA med riktig aminosyre. Når det aktiverte tRNA kommer inn i ribosomet, parer dets antikodonbase seg med det komplementære kodonet på messenger -RNA til den ene enden, og aminosyren passer til den voksende polypeptidkjeden i den andre enden. Dette er et spektakulært eksempel på dobbel plikt, multitaskings kunnskap. Men er det bare én? Hvorfor er dette viktig?
Hvorfor er dette viktig? Annet enn at Tom og Tim ble "evolusjonært bevart" --lenke :-), var det alt de tilbød Darwin.
Annet enn at Tom og Tim ble "evolusjonært bevart" --lenke :-), var det alt de tilbød Darwin. Hvordan dobbelt målrettede proteiner og omdirigering påvirker fluksen av andre molekyler enn proteiner, for eksempel membranlipider er fortsatt et tema for fremtidig forskning.
Hvordan dobbelt målrettede proteiner og omdirigering påvirker fluksen av andre molekyler enn proteiner, for eksempel membranlipider er fortsatt et tema for fremtidig forskning.